Эмбриологические аспекты ЭКО/ИКСИ

Яйцеклетки (ооциты) полученные во время трансвагинальных пункций в программе ЭКО
- Эмбриологический этап ЭКО начинается с просмотра фолликулярной жидкости после пункции фолликулов,которая содержит яйцеклетки, которые окружены клетками кумулюса (трофическими клетками, выполняющими питательную функцию). Такие ооциты – кумулюсные комплексы переносят в питательную среду и помещают в инкубатор, где они ожидают оплодотворения сперматозоидами
- Оплодотворение проводится сконцентрированной спермой через 4-6 часов после получения яйцеклеток
- При тяжелых формах мужского бесплодия, при которых существенно снижена оплодотворяющая способность спермы, выполняется процедура ИКСИ (интрацитоплазматическая инъекция сперматозойда).
День 1. Эмбрионы — оплодотворенные яйцеклетки
- Через 16-18 часов после того, как яйцеклетки и сперматозоиды помещаются вместе, проводится оценка оплодотворения. Оплодотворенная яйцеклетка имеет два пронуклеуса, представляющих хромосомы от мужчины и женщины и двух полярных тел, хромосом, которые были экструдированы после завершения мейоза.
- Иногда мы увидим три пронуклеуса в оплодотворенной яйцеклетке, это значит, что в оплодотворении учавствовал более, чем один сперматозоид или это может свидетельствовать об аномалиях развития сперматозоида в процессе сперматогенеза или яйцеклетки в оогенезе. Такие яйцеклетки, а так же неоплодотворившиеся яйцеклетки в дальнейшем не используются. Нормально оплодотворившиеся яйцеклетки продолжают культивировать дальше.
День 2. Эмбрионы — классификация качества
- На 2-е сутки после слияния генетического материала сперматозоида и яйцеклетки происходит дробление – деление клетки на две.
Клетки дробящего эмбриона называются бластомерами. На этой стадии можно оценить качество эмбриона по степени фрагментации (объему эмбриона, занимаемому безъядерными фрагментами цитоплазмы), считается, что чем она больше, тем ниже считается потенциал этого эмбриона к имплантации и дальнейшему развитию. Помимо фрагментации оценивается форма и относительные размеры бластомеров (T. Hardson, 2001). - Наиболее общепринятая классификация дробящихся эмбрионов по качеству – A-B-C-D, где А – самый лучший, D – самый худший. Цифрами указывают количество бластомеров.
Оценка качества эмбрионов по степени фрагментации (A. VanSteiterghemetal., 1995)
— Тип A — эмбрион отличного качества без ануклеарных (безъядерных) фрагментов (4А)
— Тип В — эмбрион хорошего качества с содержанием ануклеарных фрагментов до 20% (4В)
— Тип С — эмбрион удовлетворительного качества с содержанием ануклеарных фрагментов от 21% до 50% (4С)
— Тип D — эмбрион неудовлетворительного качества с содержанием ануклеарных фрагментов более 50% (4D)
День 3. Эмбрионы
На 3-и сутки эмбрион уже состоит из 6-8 бластомеров. До этого момента эмбрион развивался как бы «по инерции», исключительно на материнских «запасах», накопленных в яйцеклетке за время ее роста и развития в яичнике. Если «генетическая книга», в которой закодирована программа нормального развития эмбриона, содержит ошибки, эмбрион останавливается в развитии. Это природный процесс отбора генетически нормальных эмбрионов. Поэтому именно на стадии 4-8 бластомеров 4-19% эмбрионов останавливаются в развитии (так называемый «блок развития»).
День 4. Морула
На 4-е сутки развития эмбрион человека состоит уже, как правило, из 10-16 клеток, межклеточные контакты постепенно уплотняются и поверхность эмбриона сглаживается (процесс компактизации) – начинается стадия морулы (от лат. Morulae – тутовая ягода). Именно на этой стадии invivo (в организме матери) эмбрион попадает из маточной трубы в полость матки. К концу 4-х суток развития внутри морулы постепенно образуется полость – начинается процесс кавитации.
День 5. Бластоцисты
Перенос бластоцисты (перенос на 5-е сутки) имеет большую частоту успешной имплантации, позволяя переносить меньшее количество эмбрионов высокого качества, снижать риск многоплодной беременности при увеличении частоты наступления беременности.
- 5-6 день эмбриологического развития.
С того момента как полость внутри достигает 50% ее объема, эмбрион называется бластоцистой - Бластоциста состоит из 2-х популяций клеток – трофобласт (наружный слой) и внутренняя клеточная масса
- Трофобласт отвечает за имплантацию — внедрение эмбриона в маточный эпителий (эндометрий). Клетки трофобласта в дальнейшем превращаются в плаценту
- Внутренняя клеточная масса дает формирование тканям и органам будущего ребенка
- Чем больше полость бластоцисты и лучше развита внутренняя клеточная масса и трофобласт, тем больше потенциал эмбриона к имплантации.
Развитие бластоцисты и имплантация
- Бластоциста формируется к 5-6 дню эмбриологического развития
- Когда полость бластоцисты достигает значительного размера, истончившаяся за счет растяжения блестящая оболочка разрывается и начинается процесс естественного хэтчинга («выклева») эмбриона из блестящей оболочки, в случае затруднения естественного хэтчинга произваодится вспомогательный хэтчинг
- В течение 24 часов после окончания хэтчинга, бластоциста начинает имплантироваться (прикрепляться) в эндометрий матки
- Имплантация происходит, как правило, на 6-7 день развития эмбриона
- Бластоциста вырабатывает ХГЧ (гормон беременности), который поступает в кровь женщины и подтверждает имплантацию и наступление беременности.
Вероятность формирования бластоцисты
- Задача ЭКО и культивирования эмбрионов – получение высокого качества эмбрионов, способных развиваться и как результат – рождение здорового ребенка
- В программе ЭКО в процессе культивирования эмбрионов, только около 25-60% человеческих эмбрионов достигают развития до стадии бластоцисты к 5-му дню культивирования
- Низкий уровень развития эмбрионов до стадии бластоцисты имеет 2 основных причины:
- присущая, свойственная «слабость» человеческих эмбрионов;
- особенность культивирования эмбрионов до стадии бластоцисты.
Преимущества переноса бластоцисты в ЭКО
- При естественной беременности, 2-3 дневной эмбрион обычно находится в маточной трубе не в полости матки.
Эмбрион продолжает свое развитие и, обычно, через 80 часов после овуляции достигает матки - Имплантация эмбриона начинается обычно 2-3 дня спустя, после формирования бластоцисты и ее хэтчинга
- Поэтому, если in vitro культивирование позволяет иметь здоровую бластоцисту, перенос эмбрионов осуществляется на 5-ый день:
- эндометрий полости матки на 5-ый день переноса высоко рецептивен к перенесенному эмбриону, как при естественном зачатии, когда эмбрион попадает в полость матки.
- Перенос бластоцисты в программе ЭКО снижает риск множественной беременности
- Многие из 2-3 дневных эмбрионов не имеют способности развиваться до стадии бластоцисты, тем не менее нет 100% достоверных методов, позволяющих полностью предсказать, что перенесенный эмбрион (-ы) на 2-3 день не будет в дальнейшем развиваться адекватно в полости матки. Порой из «некрасивого» эмбриона 2-3 дневного развития родится прекрасный ребенок!
- В настоящее время имеются высокотехнологичные специальные среды для культивирования эмбрионов, что обеспечивает высокий уровень формирования бластоцисты.
Недостатки переноса бластоцисты – удорожание программы ЭКО.
Вспомогательный хэтчинг
Одним из основных факторов, от которого зависит успех лечения бесплодия методом экстракорпорального оплодотворения является способность эмбриона имплантироваться в стенку матки.
Яйцеклетка человека и эмбрион на ранних стадиях развития окружены защитной двухслойной оболочкой (zona pellucida – блестящая оболочка).
Она играет очень важную роль:
- после проникновения сперматозоида в яйцеклетку, оболочка изменяет свою структуру, не пропуская остальные сперматозоиды.
- облегчает транспорт оплодотворенной яйцеклетки по маточной трубе к полости матки.
В норме на 5-7 день развития эмбрион выходит («выклевывается») из оболочки и это процесс называется хетчинг (от англ. hatch — вылупляться из яйца, проклевываться).
Оболочка эмбриона может быть очень толстой и плотной, и это может мешать его нормальному прикреплению к стенке матки.
Считается, что у «лабораторных» эмбрионов может снижаться выделение специальных ферментов, которые растворяют оболочку, делают её тоньше, способствуя выходу эмбриона. Поэтому было разработано искусственное подобие хетчинга, которое так и назвали – вспомогательный хэтчинг.
Суть метода вспомогательного хетчинга – искусственное истончение блестящей оболочки эмбриона различными способами:
- механически (с помощью специальных микроинструментов)
- химически (с помощью кислого раствора Тироде)
- с помощью лазера. Это наиболее передовой, быстрый и безопасный для эмбриона способ проведения вспомогательного хетчинга
Для этой процедуры мы используем лазерный аппарат OCTAX Laser Shot ТМ (Германия).
OCTAX Laser Shot ТМ — это передовая лазерная технология для ВРТ с цифровым управлением, цифровой обработкой, использованием последних компьютерных технологий и оптики высокого качества.
Суть метода лазерного хетчинга — это использование лазерного луча, что позволяет сделать высокоточный надрез необходимого размера. Лазерный хэтчинг делается только эмбрионам, предназначенным для переноса. Для этого эмбрион фиксируется микропипеткой и высокоточным лазером делается небольшое отверстие в наружной части его оболочки или несколько насечек для истончения ее слоя.
Лазерный хэтчинг практикуется в ведущих центрах всего мира. Исследования утверждают, что его использование повышает шансы наступления беременности (для пациентов которым показана эта процедура). Нет никаких данных о негативном влияние хэтчинга на результат программы лечения бесплодия, эта процедура абсолютно безопасна для самого эмбриона.
Лазерный хэтчинг назначается:
- Женщинам старше 38 лет, поскольку с возрастом zona pellucida утолщается и становится твердой.
- Пациентам, имеющим предыдущие неудачные попытки ЭКО при эмбрионах хорошего качества.
- При переносах размороженных эмбрионов.
- Пациентам с повышенным уровнем ФСГ
- Женщинам, которые от природы имеют яйцеклетки с толстой zona pellucida.
Криоконсервация эмбрионов
Одной из стремительно развивающихся технологий является замораживание или криоконсервация эмбрионов и яйцеклеток с последующим долговременным хранением. Первая беременность, полученная при переносе замороженных эмбрионов человека, наступила ещё в 1983 году. С этого момента технологии криконсервации совершенствовались, отрабатывались и проверялись исследователями и временем. Было установлено, что заморозка не ухудшает качества эмбрионов, но и не улучшает его. Только здоровые, крепкие эмбрионы переживают режим «заморозка / оттаивание».
Что же дает эта процедура пациентам, нужна ли она?
Конечно, нужна, особенно если в цикле ЭКО остаются «неперенесенные» эмбрионы хорошего качества. Такой случай возможен по нескольким причинам.
Во-первых, когда на пункции яичников было получено большое количество яйцеклеток, а в последствии и нормальных, жизнеспособных эмбрионов. Кстати, такой исход возможен не всегда, и пара которой предложили криоконсервацию — счастливчики.
Это дает некую подстраховку и уверенность в будущем. При удачной попытке в цикле стимуляции хранящиеся эмбрионы можно использовать для рождения второго и третьего ребенка, а в случае неудачи — повторить попытку в естественном цикле без большой гормональной нагрузки и операции.
Во-вторых, бывают случаи, когда врач принимает решение об отказе от переноса при развитии тяжелой формы гиперстимуляции (СГЯ) или по другим медицинским показаниям.
Криоконсервации можно подвергнуть и яйцеклетки. Особенно это актуально в том случае, когда женщина планирует отсрочить материнство до наступления более подходящих социально-экономических условий. С возрастом организм женщины все хуже откликается на гормональную стимуляцию, и получить достаточное количество яйцеклеток хорошего качества не всегда возможно. Новые технологии дают возможность сохранить фертильность пациентам, планирующим химио- и радиотерапию. Криоконсервация в этих случаях дает возможность сохранить молодые, более здоровые яйцеклетки, и в последующем родить своего биологического ребенка.
Методов криоконсервации на сегодняшний день разработано несколько. В эмбриологической лаборатории центра «Тонус МАМА» используется метод ультра быстрого замораживания — витрификация по методу доктора М. Куваямы. Эмбриологи «Тонус МАМА» считают именно его наиболее эффективным, опираясь на многочисленные статистические исследования мирового уровня. Этот метод используется в клинической практике с 2000 года.
Сегодня уже более 2000 детей родилось благодаря витрификации яйцеклеток и эмбрионов. К настоящему времени метод был значительно усовершенствован, за счёт улучшения растворов мы добиваемся отличных результатов выживаемости человеческих ооцитов и эмбрионов после оттаивания. Так, выживаемость для бластоцист составляет 99%, а для эмбрионов -98%.
При витрификации (от лат. vitrum — стекло и facio — делаю, превращаю) происходит охлаждение до температуры жидкого азота, и переход яйцеклеток и эмбрионов в твердое, стекловидное состояние. Такой особенный вид заморозки возможен благодаря действию специальных веществ — криопротекторов.
Но криопротекторы — это не естественные для клеток составляющие, они токсичны. Чтобы криопротекторы в меньшей степени успели проявить свою токсичность, процедура витрификации проводится достаточно быстро, в чем и состоит преимущество этого метода заморозки. Только эмбрионы и яйцеклетки, застывшие в виде аморфной стекловидной массы, могут долго сохранять жизнеспособность, а при осторожном размораживании их жизнедеятельность полностью восстанавливается, что повышает возможность наступления беременности.
Процедура разморозки происходит также достаточно быстро, после чего эмбрионы и яйцеклетки должны некоторое время «отдохнуть» в питательной среде.
Полное освобождение от криопротекторов происходит приблизительно за 3 часа. По прошествии этого времени эмбрион полностью восстанавливается и готов для переноса в полость матки, а яйцеклетка к процедуре оплодотворения методом ИКСИ.
Особенностью криоконсервации является уплотнение оболочки яйцеклетки или эмбриона, но эта проблема легко решается. В случае разморозки эмбриона проводят вспомогательный хэтчинг (дополнительное рассечение оболочки для выхода из нее эмбриона и удачной имплантации в эндометрий). А в случае яйцеклеки проводят оплодотворение при помощи ИКСИ, и также вспомогательный хэтчинг развившемуся эмбриону.
Таким образом, витрификация позволяет:
- избежать многоплодной беременности;
- сохранить нормальные жизнеспособные эмбрионы,оставшиеся после цикла ЭКО для последующего переноса;
- родить второго и третьего ребенка без стимуляции в естественном цикле;
- осуществлять программы донорства гамет и эмбрионов;
- сохранить эмбрионы и гаметы у пациентов, проходящих лечение рака;
- сохранить яйцеклетки по другим медицинским показаниям (напр., когда женщина страдает прогрессирующим эндометриозом, у нее нарушается функция яичников и количество яйцеклеток хорошего качества снижается);
- транспортировать биологический материал на любые расстояния.
Все это значительно увеличивает результативность процедуры ЭКО, сокращает ее стоимость и затрачиваемое время и дает возможность оказать помощь большему количеству семей, желающих иметь ребенка.
Фотографии эмбрионов человека, полученные на различных этапах витрификации
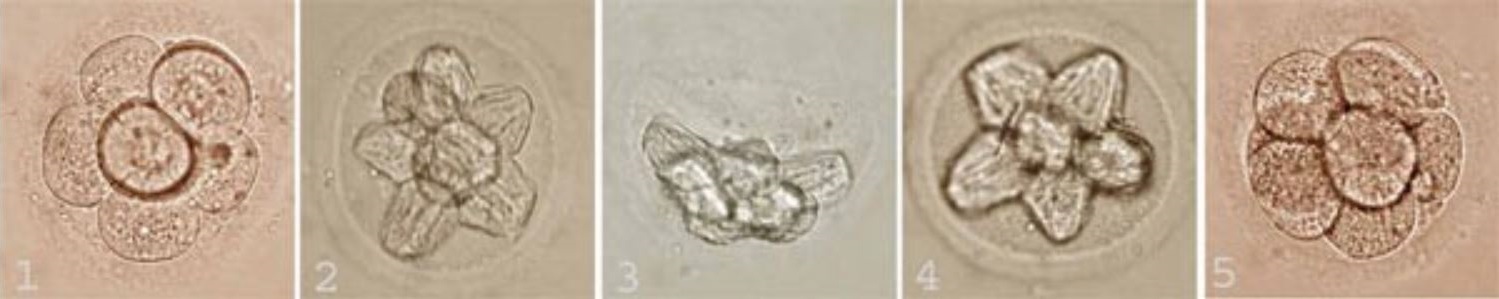
1 — эмбрион до криоконсервации;
2, 3, 4 — так выглядит эмбрион при температуре жидкого азота (?196 °C) — его клетки сильнее обезвожены, но живы;
5 — восстановление размера клеток эмбриона после разморозки (оттаивания).
Записаться на прием к акушеру-гинекологу, репродуктологу вы можете по телефону 8 (831) 411-11-20

